|
|||
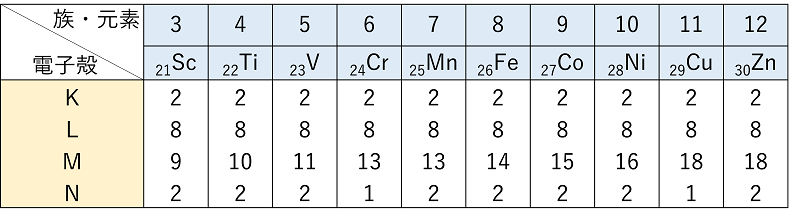
| 1 遷移元素の特色h |
|||
 |
|||
|
|||
|
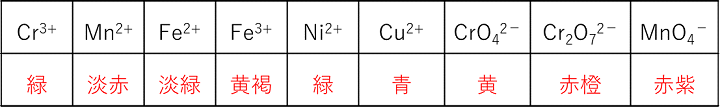
① 自身は酸化数を減少させて(還元されて),反応する相手を酸化する。 ② 遷移元素のイオンの色 |
|||
 |
|||
|
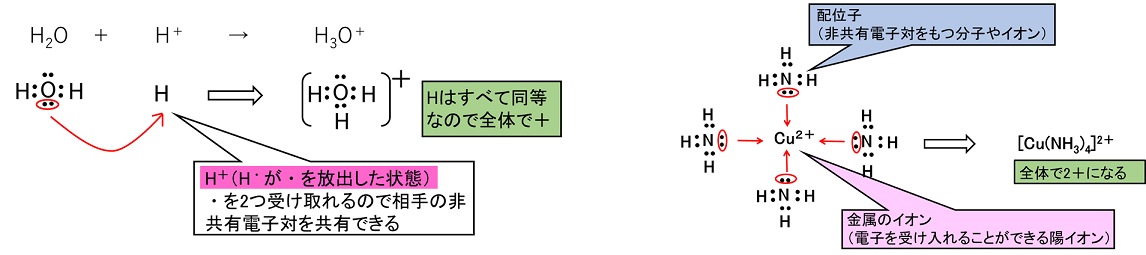
③ 通常の共有結合は,2つの原子が互いに不対電子を出し,共有してできる結合である。これに対し,2つの原子間で,一方の原子がもつ非共有電子対を共有することによってできる共有結合を〔 配位結合 〕という。 例)オキソニウムイオンH3O+ … H2Oの非共有電子対にH+が共有結合した形(左下) |
|||
 |
|||
|
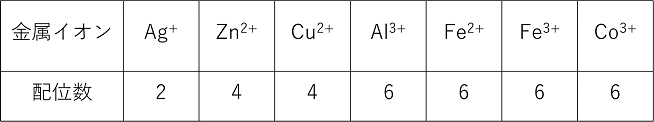
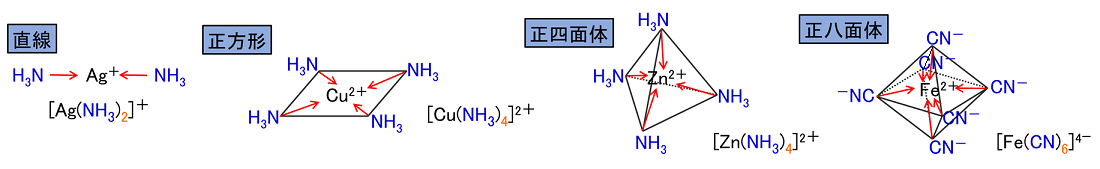
NH3などの非共有電子対をもつ分子は,金属のイオンに配位結合することができる。金属のイオンは陽イオン(原子が電子を放出してできたイオン)なので,NH3などが持つ非共有電子対を共有することができる。このときできるイオンを〔 錯イオン 〕といい,NH3などの分子を〔 配位子 〕という(右上)。 配位子には,分子や陰イオンがあり,つぎのようなものがある。 H2O(アクア),NH3(アンミン),OH-(ヒドロキシド),CN-(シアニド),Cl-(クロリド) 配位数:金属イオンに配位する配位子の数を配位数といい,金属イオンの種類にのよりほぼ決まっている。 |
|||
 |
|||
|
錯イオンの電荷数:金属イオンと配位子の電荷の和になる。 錯イオンの形:錯イオンの形は,その配位数によって次のような形をとる。 直線型(2配位),正方形(4配位),正四面体(4配位),正八面体(6配位) |
|||
 |
|||
|
|||
| 2 銅とその化合物h |
|||
|
|||
|
① (希硝酸)〔 3Cu + 8HNO3
→ 3Cu(NO3)2 + 2NO + 4H2O 〕(無機化学の反応式 パターン6 銅と硝酸 ⇒ 硝酸塩+NO,NO2+α) (濃硝酸)〔 Cu + 4HNO3 → Cu(NO3)2
+ 2NO2 + 2H2O 〕 (熱濃硫酸)〔 Cu + 2H2SO4 → CuSO4
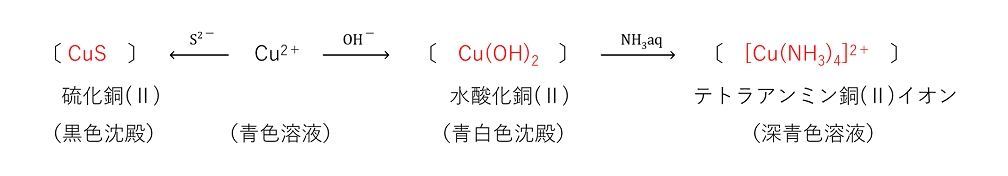
+ SO2 + 2H2O 〕 (無機化学の反応式 パターン5 銅と熱濃硫酸 ⇒ 硫酸塩+SO2+α) ② |
|||
 |
|||
|
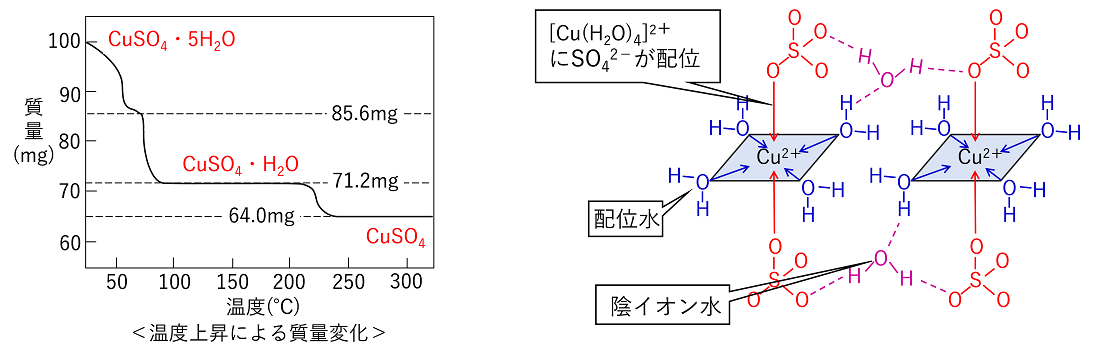
硫酸銅(Ⅱ) 五水和物CuSO4·5H2Oの結晶について 硫酸銅(Ⅱ)五水和物CuSO4·5H2O 100mgを徐々に加熱しながら質量を測定すると,左下図のようになる。初めから95℃あたりで大きな質量変化がみられ,さらに200~250℃で質量変化がみられる。また,計算すると100~200℃ではCuSO4·H2O,250℃以上でCuSO4あることがわかる。これは,CuSO4·5H2Oの結晶中の4つのH2Oと残りの1つのH2Oで取れやすさが異なるためである。 Cu2+の配位数は4であることから,CuSO4·5H2Oの結晶中では4つのH2OはCu2+に配位結合し,残りの1つのH2Oは,SO42-や他のH2Oと水素結合していると考えることができる(右下図)。 |
|||
 |
|||
|
3 銀とその化合物h |
|||
|
|||
|
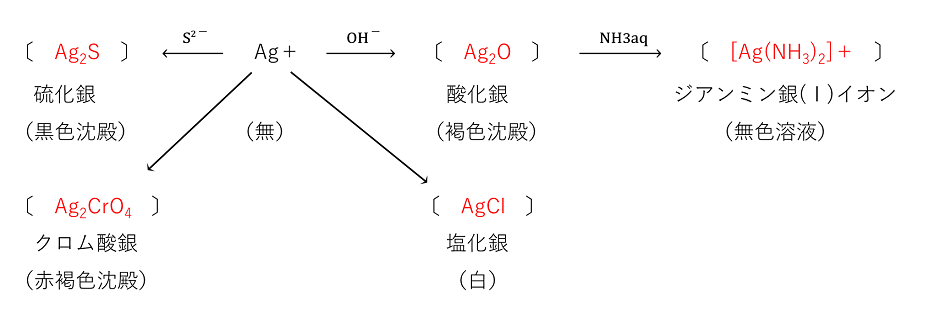
① |
|||
 |
|||
|
|||
|
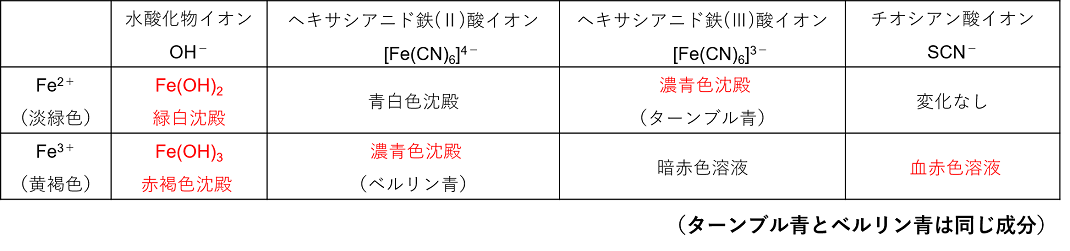
① |
|||
 |
|||
|
② Al,Feは濃硝酸のような酸化力のある酸を接触させると,金属の表面が酸化され酸化物の膜(酸化被膜)ができる。AlやFeの酸化被膜は緻密なため,内部を保護してしまう。この状態を不動態という。 |
|||
|
|||
|
① 〔 Cr2O72- + 14H+ + 6e- → 2Cr3+ + 7H2O 〕(Crの酸化数の変化 +6 → +3) ② 〔 2CrO42- + 2H+ → Cr2O72- + H2O 〕 色の変化(黄→赤橙) 〔 Cr2O72- + 2OH- → 2CrO42- + H2O 〕色の変化(赤橙→黄) ③ PbCrO4〔 黄 〕色, Ag2CrO4〔 赤褐 〕色,BaCrO4〔 黄 〕色 ④〔 MnO4- + 8H+ + 5e- → Mn2+ + 4H2O 〕MnO4-の半反応式 ⑤ 過酸化水素H2O2分解の触媒 2H2O2 → O2 + 2H2O 塩化水素を酸化させて塩素を発生させる4HCl + MnO2 → MnCl2 + Cl2 + 2H2O 酸化剤・還元剤の半反応式の作り方 例) ニクロム酸カリウム ① Cr2O72- → 2Cr3+ を覚える ② Oの数をH2Oで合せる Cr2O72- → 2Cr3++ 7H2O ③ Hの数をH+で合せる Cr2O72-+ 14H+ → 2Cr3++ 7H2O ④ +,-を電子e-で合せる Cr2O72-+14H++6e-→2Cr3++7H2O |
|||
 |
